锂离子电池
可充放电的蓄电池。具备电压高、比能量大、循环寿命长、安全性能好等特点。
发展历程
1970年,埃克森公司的M.S.惠廷厄姆[注]发现以二硫化钛(TiS2)作为正极材料,与金属锂匹配的电池电压高达2伏。然而,由于金属锂活性高,枝晶生成与不可控生长导致了电池迅速失效,严重时可能引起爆炸,存在极大的安全隐患。1980年,J.B.古迪纳夫[注]发现钴酸锂(LiCoO2)层状材料,可将电压提高到4伏。钴酸锂材料的研发是锂离子电池领域的重大突破,仍是锂离子电池的主力正极材料。1985年,日本科学家吉野彰[注]采用石油焦作为负极,匹配钴酸锂材料,发明了可用于商业的锂离子电池。1991年,日本索尼公司正式发布了首个商用锂离子电池。1997年,古迪纳夫发现磷酸铁锂(LiFePO4)材料具备高容量、高循环稳定性以及高安全性等特点,可以满足锂离子电池的要求,也是商业化正极材料之一。2000年以来,锂离子电池发展进入新阶段,开发兼备高安全性及高能量密度的锂离子电池成为研究热点。惠廷厄姆、古迪纳夫、吉野彰也因发展锂离子电池共同获得2019年诺贝尔化学奖。 锂离子电池主要组成包括正/负极材料、集流体、电解质、隔膜以及合适的电池外壳等(图1)。常见的正极材料有磷酸铁锂(LiFePO4)、钴酸锂(LiCoO2)以及锰酸锂(Li2MnO3)等。负极材料多采用石墨。正极集流体为铝箔,负极集流体为铜箔。电解质包括聚合物类电解质以及非水系液态电解质。隔膜一般为多孔聚合物,既不影响锂离子的输运也能有效隔绝正负极直接接触,避免工作状态下发生的电池短路。

工作原理
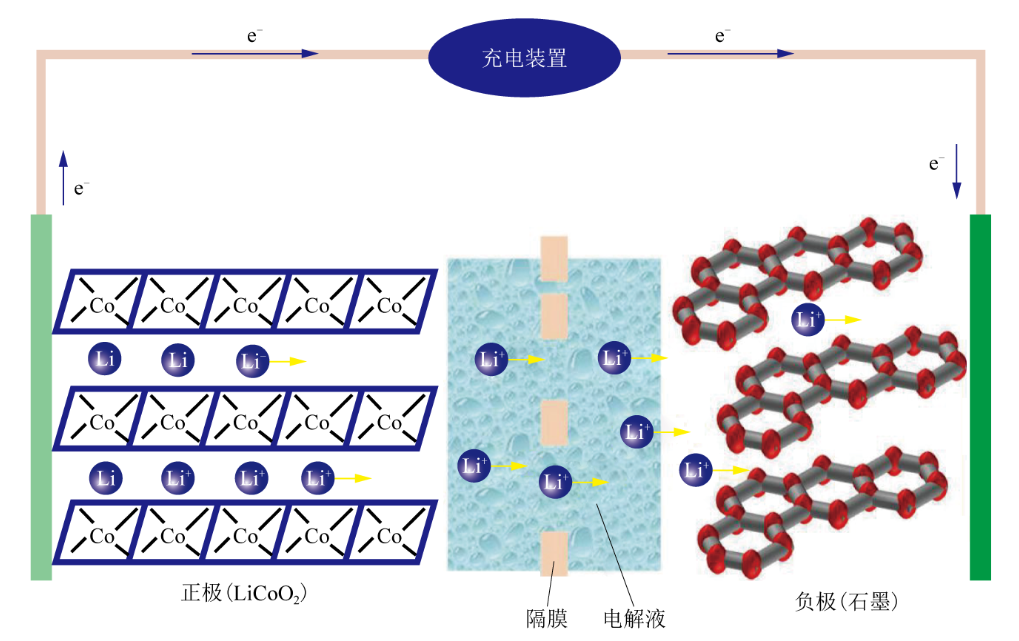
电池充电过程中,锂离子从正极材料中脱嵌,经电解质输运通过隔膜向负极迁移,得到电子后嵌入负极材料晶格中(图2);放电过程中,负极材料嵌入的锂会失去电子成为锂离子,重新迁移到正极材料晶格中。
以LiFePO4和石墨负极匹配的锂离子电池为例,其充电过程中反应如下,放电过程即为如下反应的逆过程。
正极反应:LiFePO4→Li1-xFePO4+xLi++xe-
负极反应:xLi++xe-+C→LixC
电池总反应:LiFePO4+C→Li1-xFePO4+LixC


